
Il 1905 rappresenta l'annus mirabilis per Einstein che esordì con 5 articoli https://www.edizionidedalo.it/10028-large_default/l-anno-memorabile-di-einstein-memorabili.jpg rispettivamente: sulle dimensioni molecolari (sulle moli); sul moto browniano; uno riguardante la natura della luce; quello sulla teoria della relatività ristretta; una appendice riguardo la famosissima equazione E = mc2. Da questi lavori nacque sia la teoria della relatività sia la meccanica quantistica, dalla quale però Einstein successivamente prese le distanze, almeno per quanto riguarda l'interpretazione di Copenaghen di cui fu promotore Werner Heisenberg (ovvero il principio di indeterminazione come proprietà della materia stessa). https://slideplayer.it/slide/12251774/72/images/1/1905%252C+Annus+Mirabilis.jpg
 Iniziamo dall'articolo che parla delle moli o dimensioni delle molecole. Questo articolo è molto importante perché al tempo di Einstein e l'esistenza dell'atomo era ancora una scelta teorica più che una vera e propria verità sperimentale. https://www.robertoocca.net/fis/el/el_car/atomo_nucleare_3_orbite.gif Einstein intuì la loro realtà e contribuì con un metodo matematico di calcolo a determinare le moli, questa misura oggi è detta numero di Avogadro (Amedeo) ovvero dallo scienziato che per primo si occupò dell'argomento. Questo primo lavoro di Einstein è lo sviluppo della tesi che egli presentò all'Università di Zurigo per conseguire il dottorato e riguarda la determinazione delle dimensioni delle molecole e il loro numero in una data quantità di sostanza. Questo lavoro all'epoca di Einstein risultava ancora pionieristico infatti in buona parte riprendeva l'interpretazione atomistica, che idealmente si rifaceva a quella della Grecia antica, ma che chiaramente poggiava su basi ben diverse all'epoca di Einstein, e che era ancora una semplice ipotesi. All'inizio dell'800 il fisico italiano Amedeo Avogadro https://www.aif.it/wp-content/uploads/fisici/Amedeo_Avogadro_di_Quaregna.jpg aveva formulato l'ipotesi che volumi uguali di gas contenessero lo stesso numero di molecole, in quel periodo non si era in grado di distinguere le molecole dai loro costituenti ovvero gli atomi, questo valore oggi è noto come il numero di Avogadro e sappiamo che assume dei valori estremamente grandi con cifre a 23 zeri. https://www.chimica-online.it/download/immagini_download/numero-di-avogadro.jpg
Iniziamo dall'articolo che parla delle moli o dimensioni delle molecole. Questo articolo è molto importante perché al tempo di Einstein e l'esistenza dell'atomo era ancora una scelta teorica più che una vera e propria verità sperimentale. https://www.robertoocca.net/fis/el/el_car/atomo_nucleare_3_orbite.gif Einstein intuì la loro realtà e contribuì con un metodo matematico di calcolo a determinare le moli, questa misura oggi è detta numero di Avogadro (Amedeo) ovvero dallo scienziato che per primo si occupò dell'argomento. Questo primo lavoro di Einstein è lo sviluppo della tesi che egli presentò all'Università di Zurigo per conseguire il dottorato e riguarda la determinazione delle dimensioni delle molecole e il loro numero in una data quantità di sostanza. Questo lavoro all'epoca di Einstein risultava ancora pionieristico infatti in buona parte riprendeva l'interpretazione atomistica, che idealmente si rifaceva a quella della Grecia antica, ma che chiaramente poggiava su basi ben diverse all'epoca di Einstein, e che era ancora una semplice ipotesi. All'inizio dell'800 il fisico italiano Amedeo Avogadro https://www.aif.it/wp-content/uploads/fisici/Amedeo_Avogadro_di_Quaregna.jpg aveva formulato l'ipotesi che volumi uguali di gas contenessero lo stesso numero di molecole, in quel periodo non si era in grado di distinguere le molecole dai loro costituenti ovvero gli atomi, questo valore oggi è noto come il numero di Avogadro e sappiamo che assume dei valori estremamente grandi con cifre a 23 zeri. https://www.chimica-online.it/download/immagini_download/numero-di-avogadro.jpg
Fu proprio con la possibilità di determinare con precisione il numero di Avogadro che si affermò in modo decisivo la fisica delle particelle, che fino a quel momento era soltanto una delle tante ipotesi che riguardavano il problema della materia e della sostanza. Il primo problema da affrontare sulla questione era che tutte le misure che potevano essere eseguite a livello macroscopico erano insensibili al valore del numero di Avogadro e non fornivano pertanto informazioni sperimentali su di esso.
Einstein propose di studiare una soluzione di zucchero disciolto in acqua e mostrò come le variazioni di viscosità di questo liquido permettessero di ricavare il numero di Avogadro.
Malgrado il numero ottenuto da Einstein fosse abbastanza distante da quello reale il metodo era particolarmente ingegnoso e dopo qualche anno dopo Jean Perrin (1870-1942) applicò il metodo di Einstein e ottenne dei dati estremamente più precisi. https://upload.wikimedia.org/wikipedia/commons/7/7e/Jean_Perrin_1927.jpg Per quanto possa sembrare strano questo è uno dei lavori di Einstein maggiormente visitati dagli scienziati.
L’esperimento di Einstein era molto semplice: supponiamo di sciogliere una piccola quantità di zucchero nell'acqua, le molecole di zucchero si diffonderanno nel liquido fino a raggiungere uno stato di equilibrio con esso, così ché zucchero e acqua saranno mescolati in modo uniforme. Questa diffusione dello zucchero nell'acqua produce una pressione che può essere misurata immergendo nella soluzione una striscia sottile (una carta velina per esempio) che le molecole di zucchero diffondendosi urteranno. In questo modo Einstein poteva determinare sia le dimensioni sia il numero delle molecole di zucchero presenti nella soluzione https://docplayer.it/docs-images/49/20827787/images/page_10.jpg
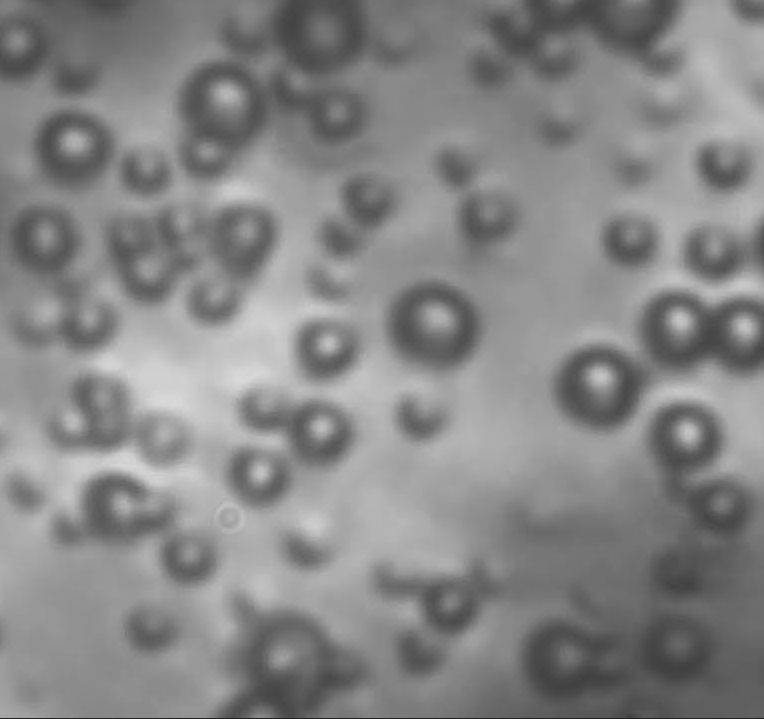 Il secondo articolo riguarda il moto browniano. Nel 1827 il botanico inglese Robert Brown aveva notato che delle particelle per esempio del polline o della polvere sottile in sospensione su una superficie acquosa, se osservate col microscopio, si muovevano con un andamento indeterminato: dopo aver percorso una distanza ogni volta diversa ogni grano di polline cambiava la direzione del suo movimento in modo casuale. https://upload.wikimedia.org/wikipedia/commons/6/6d/Translational_motion.gif Ciò da principio fece pensare al vecchio principio vitalistico della natura tanto caro ai romantici, ma che Einstein riuscì a ricondurre proprio alla natura degli atomi e delle molecole.
Il secondo articolo riguarda il moto browniano. Nel 1827 il botanico inglese Robert Brown aveva notato che delle particelle per esempio del polline o della polvere sottile in sospensione su una superficie acquosa, se osservate col microscopio, si muovevano con un andamento indeterminato: dopo aver percorso una distanza ogni volta diversa ogni grano di polline cambiava la direzione del suo movimento in modo casuale. https://upload.wikimedia.org/wikipedia/commons/6/6d/Translational_motion.gif Ciò da principio fece pensare al vecchio principio vitalistico della natura tanto caro ai romantici, ma che Einstein riuscì a ricondurre proprio alla natura degli atomi e delle molecole.
Einstein propose che il moto, detto appunto moto browniano, fosse dovuto agli urti incessanti dei granuli con le molecole del mezzo in cui erano sospesi, nella fattispecie l'acqua. Sebbene infatti i granuli di polline siano più grandi delle molecole d'acqua queste sono molto numerose e possono nel loro complesso spingere le particelle di Polline in una direzione non è un'altra. https://www.esperimentanda.com/wp-content/uploads/2018/02/z567765b.jpg
Einstein sostenne che il moto delle particelle che sono sospese in un fluido può essere descritto attraverso due azioni:
-l'esistenza di una forza di attrito viscoso che il fluido esercita su ogni particella, e che questa forza dipende dalla posizione e tende a fermare le particelle;
-il moto di agitazione termica della molecola del fluido come causa dei moti disordinati delle particelle che danno vita a un processo di diffusione;
dall'equilibrio di queste due forze deriva il moto delle particelle in sospensione sul fluido
Einstein mise poi in relazione questo spostamento con il numero di Avogadro mettendo in evidenza che lo spostamento medio era inversamente proporzionale al numero di Avogadro: la teoria di Einstein forniva finalmente ai fisici il modo per esplorare la struttura molecolare della materia essendo questo spostamento visibile al microscopio.
 Il terzo risultato ottenuto da Einstein nel 1905 è probabilmente quello che maggiormente colpi la comunità scientifica dell'epoca esso riguarda la natura della luce. Come illustrato in precedenza quando Einstein iniziò a lavorare sulle sue teorie il concetto di atomo era ancora estremamente vago è ritenuto più che altro uno stratagemma per risolvere determinate questioni che non una vera e propria realtà confermata; è in quegli anni, ed anche grazie alle teorie di Einstein, che si assunse l'atomo come realtà e con esso l'elettrone come particella. https://www.media.inaf.it/wp-content/uploads/2013/12/main-circle-1.jpg
Il terzo risultato ottenuto da Einstein nel 1905 è probabilmente quello che maggiormente colpi la comunità scientifica dell'epoca esso riguarda la natura della luce. Come illustrato in precedenza quando Einstein iniziò a lavorare sulle sue teorie il concetto di atomo era ancora estremamente vago è ritenuto più che altro uno stratagemma per risolvere determinate questioni che non una vera e propria realtà confermata; è in quegli anni, ed anche grazie alle teorie di Einstein, che si assunse l'atomo come realtà e con esso l'elettrone come particella. https://www.media.inaf.it/wp-content/uploads/2013/12/main-circle-1.jpg
Va subito detto che la scoperta dell'elettrone mise in difficoltà l'interpretazione che era stata data in precedenza del fenomeno luminoso: dopo l'esperimento di Thomas Young https://qph.fs.quoracdn.net/main-qimg-905167d3d9d6eeac2b33d217badf7da0 e lo sviluppo delle equazioni di Maxwell si era in un certo senso consolidata l'idea che la luce avesse una natura ondulatoria. Tuttavia, come abbiamo visto nel capitolo specifico, l'esperimento di Michelson e Morley https://www.youtube.com/watch?v=if3lc6jT-28 sembrava negare l'esistenza dell'etere, così che per difendere la natura ondulatoria della luce Lorentz aveva ipotizzato che un corpo che si trova in moto si contrae leggermente nella direzione del moto stesso (oggi note come leggi di trasformazione di Lorenz https://slideplayer.it/slide/2898956/10/images/2/LE+TRASFORMAZIONI+DI+LORENTZ.jpg) e questa contrazione è tanto quanto la quantità necessaria ad annullare la differenza della lunghezza dei percorsi eseguiti per esempio dai raggi luminosi nell'esperimento di Morley e Michelson.
Tuttavia rimanevano irrisolti una serie di aspetti che continuavano a gettare ombra sui risultati ottenuti, anche perché le trasformazioni di Lorentz sembravano più un artificio matematico che non con una descrizione della realtà fisica.
Oltre al problema legato alla scoperta dell'elettrone ad incrinare quanto ipotizzato fino a quel momento sulla natura della luce vi fu un altro esperimento a destabilizzare la normale evoluzione del paradigma scientifico: quello compiuto da Max Planck https://www.aif.it/wp-content/uploads/fisici/Max_Planck.jpg a proposito della cosiddetto radiazione del corpo nero.
Il problema del corpo nero era noto fin dalla metà dell'800 per opera di Gustav Robert Kirchhoff il quale immaginando una cavità vuota (pensiamo a una sfera) con le pareti annerite si domandava cosa sarebbe accaduto nel momento in cui si fosse praticato un piccolo forellino tramite il quale sarebbe stato possibile emettere le frequenze dello spettro elettromagnetico ovvero la luce visibile piuttosto che i raggi ultravioletti o quelli infrarossi. https://i.ytimg.com/vi/SEp4GJucJdQ/maxresdefault.jpg Con grande sorpresa Robert Kirchhoff scoprì che questa emissione veniva quasi completamente assorbita dal corpo nero. Questo creava grandi difficoltà concettuali secondo la visione classica.
In base alla teoria elettromagnetica l'energia irradiata da un corpo caldo era composta di onde corte e doveva quindi apparire di colore violetto e non rosso come in realtà appariva, sembrava quindi che l'energia emanata dal corpo non avvenisse in modo continuo come ci aspetteremmo da un'onda ma in modo discontinuo attraverso una serie di pacchetti di energia. https://spark.liceodesio.edu.it/pluginfile.php/6015/mod_page/content/3/blackbody.png
Al fine di risolvere questo problema nel 1900 Max Planck ebbe l'ardire di introdurre un'ipotesi eretica ovvero che gli atomi non liberassero la loro energia in modo continuo, ma che diffondessero energia in modo discontinuo: in altre parole l'energia non si trasmetteva in modo ondulatorio e continuo ma era per così dire quantizzata, ovvero composta di tante piccole quantità non ulteriormente divisibili che Max Planck chiamò quanti (quantum), a cui attribuì una grandezza oggi nota come costante di Planck 6.662607015 * 10-34 J*s. https://encrypted-tbn0.gstatic.com/images?q=tbn%3AANd9GcSYneRgLY-p35QJd7ybU1u33VBGb-mquLGarfGtsyw0esyIrAqM&usqp=CAU
Questa teoria poteva essere accettata solo ad un prezzo molto alto, perché contrastava con l'idea che nella natura non vi fossero delle discontinuità, Natura non facit saltus avevano sempre detto gli scienziati. Tuttavia la rivoluzione introdotta da Plank era solo parziale perché questa discontinuità riguardava esclusivamente i processi di emissione e di assorbimento della luce e non la natura stessa della luce, essa poteva così continuare ad essere interpretata in modo ondulatorio, ma eravamo già alle soglie della nuova interpretazione che avrebbe proposto Albert Einstein di li a poco.
Albert Einstein nel suo articolo del 1905, Un punto di vista euristico relativo alla generazione e alla trasformazione della luce, applicò l’ipotesi di Planck alla natura stessa della luce, tutto nacque dall’idea di utilizzare i termini di Planck spiegare l'effetto fotoelettrico.
Nel 1887 il fisico tedesco Herz studiando le scariche elettriche emesse dei conduttori elettrizzati da una scintilla si accorse che il numero era più intenso se gli elettrodi venivano irradiati con una luce ultravioletta https://encrypted-tbn0.gstatic.com/images?q=tbn%3AANd9GcS_U9yup3TVG2OdJzfR27yGVJNY9zaZ_l7Bl532W8-5Vd44Bd7b&usqp=CAU; 8 anni dopo Albert Einstein intuì che l'estrazione degli elettroni dal metallo poteva essere spiegata più correntemente ipotizzando che la radiazione elettromagnetica fosse costituito da pacchetti di energia ovvero da quanti, pacchetti che poi vennero denominati fotoni. Per i suoi studi sull'effetto fotoelettrico Einstein ricevette il Premio Nobel per la fisica nel 1921. L'effetto fotoelettrico è l'espulsione di elettroni da parte di metalli esposti ad una radiazione elettromagnetica, durante questo fenomeno ogni fotone interagisce singolarmente con un elettrone al quale cede la sua energia; affinché ciò si verifichi il fotone dovrà possedere un’energia tale da rompere il legame che tiene unito l'elettrone all'atomo del metallo; l'emissione di questi elettroni dipende unicamente dalla frequenza della radiazione incidente e non dalla sua intensità, generando quindi una contraddizione all'interno dell'interpretazione ondulatoria della luce. https://encrypted-tbn0.gstatic.com/images?q=tbn:ANd9GcR0AYq3hK7fmsJgO7Ni-mdqy4UjmKAWayuVSGv3x3OmKykBAPu4WA
Einstein propose di spiegare l'effetto fotoelettrico introducendo la nozione di quanto di luce il fotone:
È concepibile che una teoria della luce basata su funzioni spaziali continue porti a contraddizioni con l’esperienza se la si applica ai fenomeni della generazione e della trasformazione della luce. A me sembra in effetti che le osservazioni su certe classi di fenomeni concernenti la generazione o la trasformazione della luce appaiono più comprensibili nell’ipotesi di una distribuzione spaziale discontinua dell’energia luminosa. Secondo l’ipotesi che sarà qui considerata, quando un raggio luminoso uscente da un punto si propaga, l’energia non si distribuisce in modo continuo in uno spazio via via più grande; essa consiste in un numero finito di quanti di energia [hν]localizzati nello spazio, che si muovono senza essere divisi e che possono essere emessi o assorbiti solo nella loro interezza (Einstein, Un punto di vista euristico relativo alla generazione e alla trasformazione della luce) https://sites.google.com/site/slocontevsa/_/rsrc/1435168174880/fisica/luce3.jpg?height=271&width=400
Ovvero la luce viene assorbita in quantità discrete: i quanti di luce. In sostanza il metallo che veniva colpito da un raggio di luce emetteva elettroni di uguale velocità perché la velocità dipendeva dal colore della luce cioè dalla sua frequenza; il fotone atomo di luce con frequenza F trasferente la propria energia a un altro tipo di particella, l'elettrone con velocità V o energia E, secondo l'equazione E=1/2 mv2 = h. https://www.chimica-online.it/download/immagini_download/stato-fondamentale.jpg
Einstein affermò che nella termodinamica la radiazione monocromatica di debole intensità si comporta come se fosse costituita da quanti di energia indipendenti l'uno dall'altro, e che un'energia è direttamente proporzionale alla frequenza F della radiazione: e = hf con h indichiamo la costante di proporzionalità chiamata appunto costante di Planck.